Trabalho sobre a Lei de Hess - 2as EM
Este trabalho é proposto aos alunos do 2o ano do EM matutino e vespertino para ser feito como segue:
1-) Pode ser feito em duplas ou individual.
2-) Deve ser entregue até o próximo dia 26/11/2014 em mãos.
3-) As resoluções devem constar da folha de resposta a ser entregue.
DISCIPLINA: QUÍMICA
PROFESSOR: MÁRCIA ANTONIA /2º _____Ensino Médio NOTA:
ALUNO: ___________________________________________________________
Brusque, _____ de ___________________________ de 2014.
Avaliação 4º Bimestre
Obs:Respostas a caneta e sem rasuras, questões rasuradas serão
anuladas.Todos os cálculos devem constar da folha de prova.
1-) Cerca de 90% do ácido nítrico, principal matéria-prima dos adubos à base de
nitratos, são obtidos pela reação de oxidação da amônia pelo O2, em presença de catalisador-platina com 5% a 10% de paládio ou de ródio (ou de ambos) - a uma temperatura de 950°C. A reação é representada pela equação:
6 NH3(g) + 9 O2(g) → 2 HNO3(g) + 4 NO(g) + 8 H2O(g).
Essa reação ocorre nas seguintes etapas:
I – 6 NH3(g) + 15/2 O2(g) → 6 NO(g) + 9 H2O(g) ∆H = -1359 kJ
II – 3 NO(g) + 3/2 O2(g) → 3 NO2(g) ∆H = - 170 kJ
III – 3 NO2(g) + H2O(g) → 2 HNO3(g) + NO(g) ∆H = - 135 kJ
Com base nas informações relativas às três etapas envolvidas na produção de ácido nítrico, calcule,em KJ, a variação de entalpia correspondente à síntese de um mol desse ácido.
2-) Considere o Benzeno (C6H6) pode ser obtido a partir de hexano (C6H14) por reforma catalítica. Considere as reações de combustão:
H2(g) + ½ O2(g) ----> H2O(l) ΔH = -286 KJ/mol
C6H6(l) + 15/2 O2(g) ----> 6CO2(g) + 3H2O(l) ΔH = -3268 KJ/mol
C6H14(l) + 19/2 O2(g) -----> 6CO2(g) + 7H2O(l) ΔH = -4163 KJ/mol
Pode-se então afirmar que na formação de 1 mol de benzeno, a partir do hexano, há:
a. Liberação de 249 KJ
b. Absorção de 249 KJ
c. Liberação de 609 KJ
d. Absorção de 609 KJ
e. Liberação de 895 KJ
3-) Um passo do processo de produção de ferro metálico, Fe(s), é a redução do óxido ferroso (FeO) com monóxido de carbono (CO).Utilizando as equações termoquímicas abaixo e baseando-se na Lei de Hess, qual é o valor de“x”:
Fe2O3(s) + 3 CO(g) → 2 Fe(s) + 3 CO2(g) ∆H = -25 kJ
3 FeO(s) + CO2(g) → Fe3O4(s) + CO(g) ∆H = -36 kJ
2 Fe3O4(s) + CO2(g) → 3 Fe2O3(s) + CO(g) ∆H = +47 kJ
 FeO(s) + CO(g) → Fe(s) + CO2(g) ∆H = x
FeO(s) + CO(g) → Fe(s) + CO2(g) ∆H = x
4-) Dadas as seguintes equações termoquímicas:
2 H2(g) + O2(g) → 2 H2O(ℓ) ∆H = -571,5 kJ
N2O5(g) + H2O(ℓ) → 2 HNO3(ℓ) ∆H = -76,6 kJ
½ N2(g) + 3/2 O2(g) + ½ H2(g) → HNO3(ℓ) ∆H = -174,1 kJ
Baseado nessas equações, determine a variação de entalpia a respeito da formação de 2 mols de N2O5(g) a partir de 2 mols de N2(g) e 5 mols de O2(g).
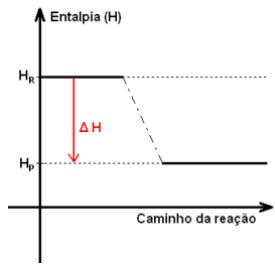
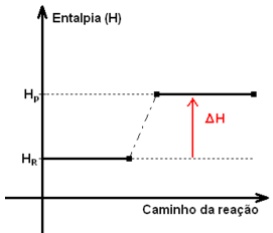
5-) O valor do ΔH da seguinte reação é difícil de se medir experimentalmente:
C (graf) + 2 H2 (g) → CH4 (g), ΔH = ?
No entanto, são conhecidos os valores de ΔH das seguintes reações:
1) C (graf) + O2 (g) → CO2 (g) ΔH = - 94,1 kcal
2) H2 (g) + ½ O2 (g) → H2O (l) ΔH = - 68,3 kcal
3) CH4 (g) + 2 O2 (g) → CO2 (g) + 2 H2O (l) ΔH3 = - 212,8 kcal
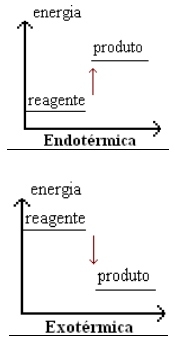
Calcule o ΔH da reação do carbono grafite com o gás hidrogênio e diga se a reação é endotérmica ou exotérmica.
Poise o ano está acabando não é?! E com ele vem os trabalhos tão temidos, esse é o ultimo trabalho proposto pela Professora Márcia Antonia, nossa queridissima professora de Quimica, que nos acompanhou em mais um ano, e é por ela que temos o nosso blog hoje! Bem esse é um trabalho onlline, onde ela posta no blog particular dela e o alunos fazem, uma otima alternativa para que as aulas possam render mais, assim podemos fazer o trabalho no conforto do nosso sofá, sem barulho, com concentração realizando assim com mais vigor e atenção, Gostou da ideia, adote você também fale com seus professores, um modo pratico e alternativo.